新規がん免疫療法開発の基礎研究
当教室のがん免疫研究チームは長い歴史がありますが、近年は新規がん治療としてのがん免疫療法、特にがんワクチン療法の開発を行っています。近年、魅力的な治療法として確立された免疫チェックポイント阻害剤は、腫瘍反応性T細胞の免疫抑制を解除することで腫瘍に対するT細胞の免疫応答を増強します。一方、がんワクチン療法は、合成したワクチン抗原をいわばがんに対する目印として免疫することで、腫瘍を特異的に攻撃するT細胞を選択的に誘導活性化します。免疫チェックポイント阻害剤が、がんに対する免疫応答の“ブレーキを外す”治療法であるのに対して、がんワクチン療法は“アクセルを踏む”治療法といえます(図1)
強力ながんワクチンの開発には、適切な標的抗原、免疫アジュバント、治療対象などを選択し理想的な組み合わせを探索、検証する必要があると考え、基礎的研究を進めています。
がんワクチンにおける理想的な標的抗原の探索に関する基礎研究として、我々は膵癌の進展に関連する重要な分子がMUC16とmesothelinであることを明らかにし(Cancer Sci. 2012)、これらを標的とするエピトープペプチドを同定してきました(Oncotarget.2018)。なお、mesothelin遺伝子を導入した樹状細胞が、膵癌細胞に対してmesothelin特異的な細胞障害を誘導することも示しました(Cancer Lett.2011)。また、これまでに、HIG2(PLoS One. 2014)、KIF20A(J Biomed Biotechnol. 2012)などの臨床応用が有用と考えられる標的に対するエピトープペプチドを同定しています。
がんワクチンの効果を増強する免疫アジュバントの開発においては、特にTLR-9アゴニストのCpG-ODNに着目し、がんワクチンアジュバントとしての有用性をヒトin vitroで示すとともに(Int J Oncol. 2011)、改変型CpG-ODNの全身投与が腫瘍局所の免疫環境を変化させることで強力な抗腫瘍効果を認めることを明らかにしています(Oncotarget.2016)。
腫瘍局所の免疫環境が腫瘍の進展に与える影響の解析においては、これまでサイトカインIL-17に注目して検討してきました。ヒトの胃癌では腫瘍に浸潤するTh17細胞から分泌されるIL-17が腫瘍の進展を促進することがあきらかとなった一方で(Oncol Rep. 2011)、根治切除術を施行した胃癌患者における術中腹腔洗浄液中のIL-17mRNA高発現は予後延長の独立した因子であることがわかり(Oncol rep.2014)、IL-17が腫瘍局所と腹腔内では腫瘍進展に異なる効果を示すことが示唆されました。担癌マウスを用いた検討では腫瘍局所のIL-17Aを制御すると腫瘍浸潤リンパ球の細胞障害活性が増強することを示しました(PLos One. 2013)。このような腫瘍局所免疫環境の解析をすすめ、新規コンセプトの免疫療法やバイオマーカーを開発することで、がんワクチンにおいても複合免疫療法や有効治療対象の選択につながると考え、現在も様々な角度からの解析をすすめています。
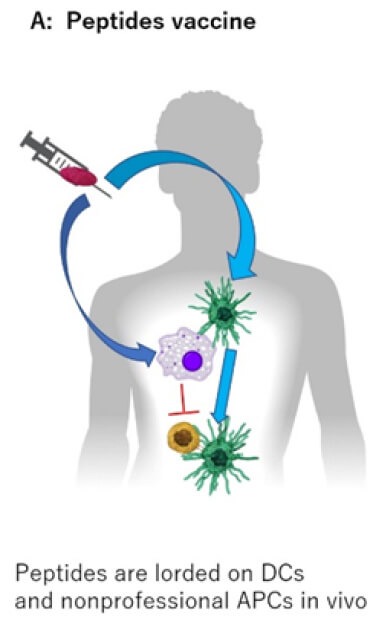
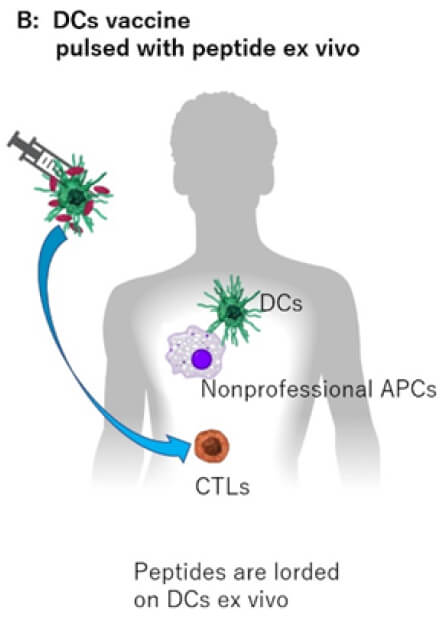
また、ワクチンによる特異的T細胞誘導をより強力にするコンセプトで、抗原を生体内で抗原提示細胞に選択的に送達させる新規がんワクチンの開発を進めています(Trends in immunoth.2017)(図2)。我々が開発するXCR1に対するリガンドであるXCL1と抗原を連結させた新規ワクチンは、cross presentationに優れるXCR1-DCに生体内で選択的に送達されることで効率よく特異的T細胞が誘導され、強力な腫瘍増殖抑制を示すことがわかりました(論文投稿中)。免疫チェックポイント阻害剤との併用による相乗効果も示され、さらなる開発を進めています。
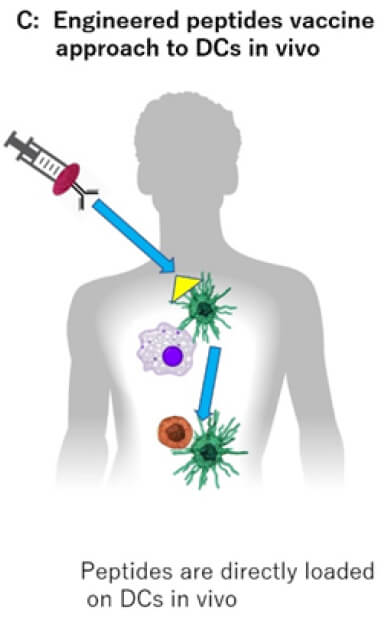

iPS細胞由来樹状細胞を用いた
ワクチン療法に関する基礎研究
樹状細胞(DC)は最も強力な抗原提示細胞であり、抗原特異的な免疫応答の形成において司令塔としての役割を担っています。当教室では癌免疫療法の治療戦略として、DCに腫瘍関連抗原(TAA)遺伝子を導入し、TAA特異的な細胞傷害性Tリンパ球(CTL)を誘導する手法を検討してきました(Clin Cancer Res. 2002,Oncology. 2005,Int J Oncol. 2006,Int J Cancer. 2006,Cancer Lett. 2011)。ただ樹状細胞ワクチン療法を臨床応用する場合、樹状細胞を得るためには複数回のアフェレーシスを要するため患者さんの負担が大きいこと、さらに担癌患者由来の樹状細胞は成熟能が低く、抗原提示能や遊走能も低いとされ (Cancer Immunol Immunother. 2012)、癌免疫抑制に働くとの報告もあります (Oncoimmunology. 2015)。これらの問題を解決するために、安定した数と機能のDCを供給できる新規ツールとしてiPS細胞に着目し、2010年より継続してiPSDCワクチン療法の研究を行っています。少量の末梢血からiPS細胞を樹立し、それをDCに分化誘導することで、患者さんからの採血は理論上1回少量のみでiPSDCが得られること、また一旦遺伝子を初期化するため担癌患者さんの免疫疲弊の影響を克服できる治療戦略であると考えています。
これまでの当教室におけるiPSDCワクチンの基礎研究の概要を以下に示します。
マウスを対象とした研究
メラノーマ腫瘍モデルを用いて、マウスiPSDCは骨髄由来DCと同等の抗原提示能を有しており、TAAであるgp100遺伝子導入iPSDCワクチンは骨髄由来DCワクチンと同等の抗腫瘍効果を示したことを報告しました(Int J Cancer. 2014)。さらにヒトに近いモデルであるCEAトランスジェニックマウスを用いて、ヒト腫瘍抗原遺伝子であるCEA遺伝子をiPSDCに導入したがんワクチン療法は強い抗腫瘍効果を示しました(Sci Rep. 2018)。
健常人を対象とした研究
健常人を対象としたin vitro系において、CEA遺伝子を導入したiPSDCはCEA特異的なCTLが誘導可能であることを確認し報告しました(Sci Rep. 2018) 。
担癌患者を対象とした研究
結腸癌患者由来のiPSDCに腫瘍由来RNAを導入することで、腫瘍特異的なCTLが誘導可能であること、さらにそのCTLは腫瘍のneoantigenも認識し、免疫応答可能であることを確認し報告しました(Sci Rep. 2022)。腫瘍由来のRNAを導入したiPSDCでは理論上腫瘍由来のあらゆる抗原に対しするCTLを誘導できるため、それぞれの患者さんの個別化治療につながる可能性があります。
抗腫瘍効果を高める工夫
樹状細胞の抗原提示の過程でも重要な、TAAの蛋白分解の機構であるユビキチンプロテアソーム系に着目し、Ubiquitin-Mesothelin融合遺伝子導入iPSDCでCTLを誘導することで、抗原提示能が向上し、得られるCTLの数が増加し、抗腫瘍効果も増強する可能性を示しました。
今後は、このiPS細胞由来樹状細胞と免疫チェックポイント阻害剤や既存の抗がん剤を組み合わせた複合免疫療法・化学療法など、治療の選択肢が広がる可能性があります。今や免疫療法は手術療法、化学療法、放射線療法に次ぐ第4の治療として確立されています。少しでも早く、iPS細胞由来樹状細胞癌ワクチン療法をがん患者さんに提供できるよう今後も精力的に研究を続けていく予定です。
iPS細胞由来樹状細胞ワクチン療法の治療戦略
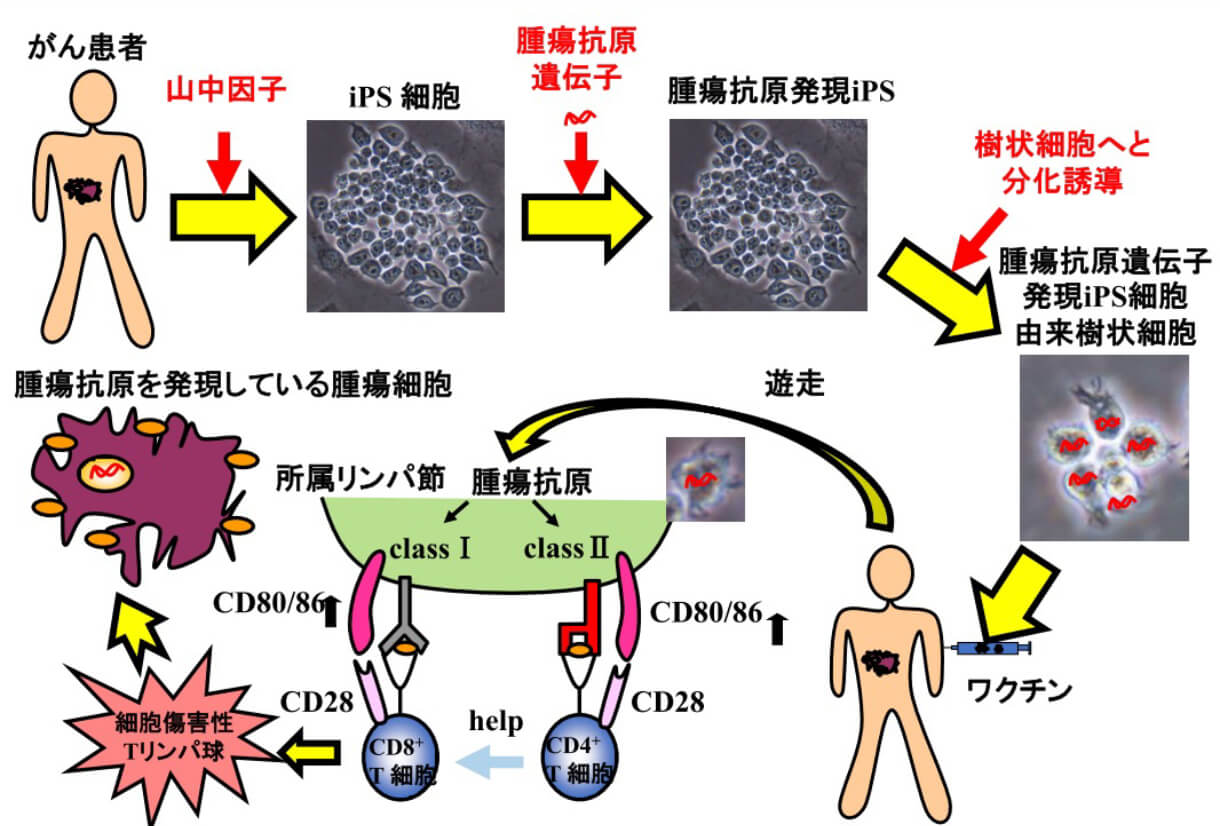
iPSDCsを用いたテーラーメードがんワクチン療法
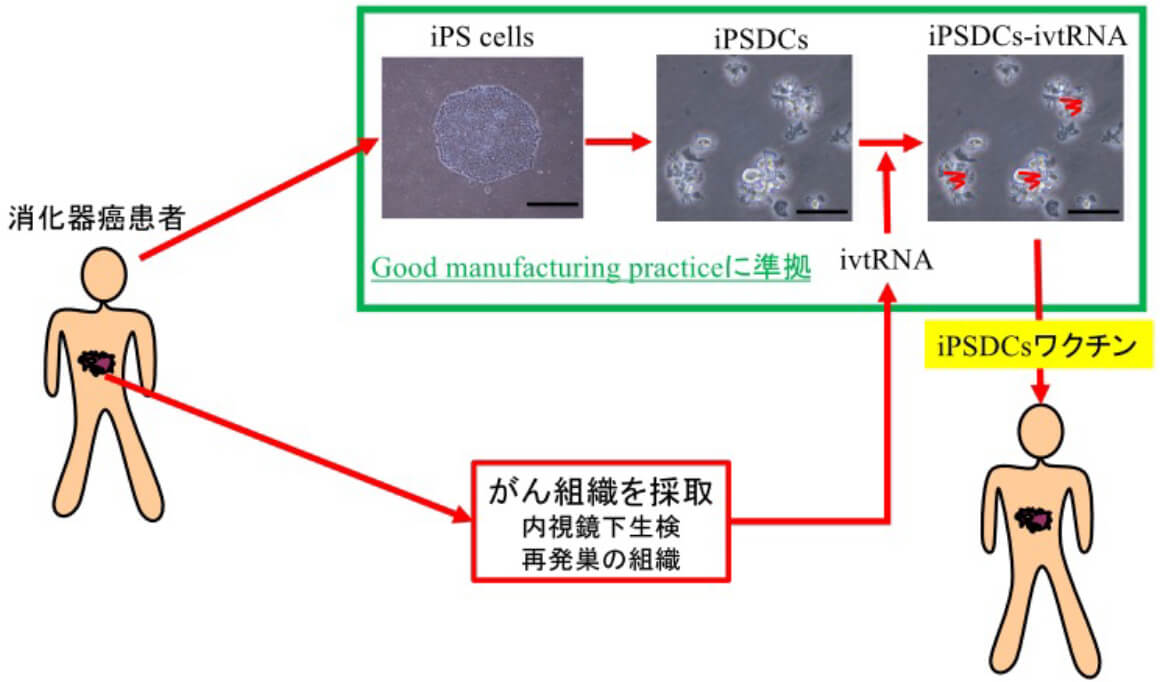
RNAは増幅できることより、少量の組織サンプルよりがんワクチンの作成が可能である
再発症例などで、遺伝子変異のプロファイルが原発巣と異なる場合にも対応し得る可能性がある

タンパクメチル化をターゲットとした
新規分子標的治療薬の開発
エピジェネティクスはさまざまな疾患に関与しており、がんの発生・増殖・進行においても重要な役割を果たしている。中でもヒストンを含むタンパクに対する翻訳後修飾は、クロマチン構造の変化・タンパク量の変化などを通じて遺伝子発現の変化を引き起こす。本研究テーマは、東京大学医科学研究所 中村祐輔先生・浜本隆二先生(当時)のご指導の下、速水が脱メチル化酵素KDM5B/JARID1Bが肺癌・膀胱癌において高発現し、下流にあるE2F1/E2F2の制御によりがんの増殖に関わっていること(Mol Cancer. 2010)、マイクロアレイによるパスウェイ解析から脱メチル化酵素LSD1がクロマチン制御を通してがんの増殖に関与していること(Int J Cancer. 2011)、メチル化酵素SMYD2がRB1(retinoblastoma 1)810番目のリジン残基のメチル化を通してRB1のリン酸化を制御していること(Neoplasia. 2012)を報告した。当教室では2011(平成23)年より、タンパクメチル化をターゲットとした、新規分子標的治療薬の開発を目指し研究を開始している。
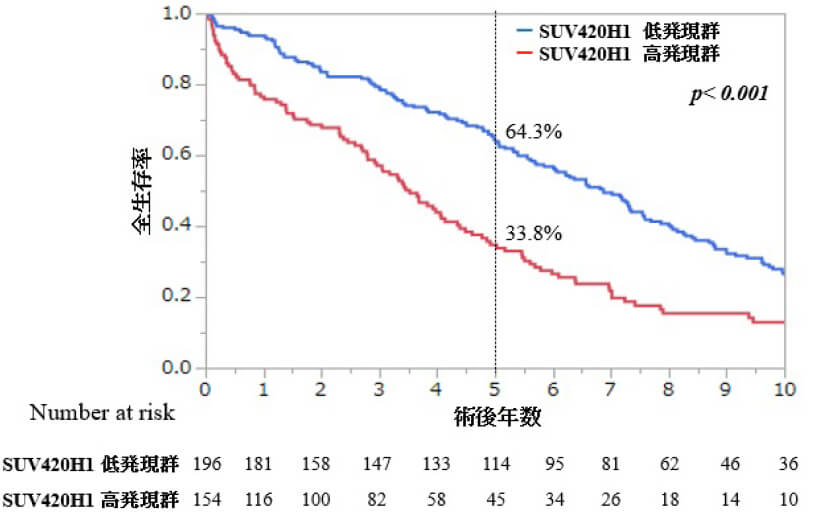
現在、肝胆膵悪性腫瘍(肝細胞癌・肝内胆管癌・膵癌)に対し、タンパクメチル化が関与するがん増殖・転移のメカニズム解明を目指し研究を続けている。重河は脱メチル化酵素KDM5B/JARID1Bが肝細胞癌において高発現し、特にB型・C型肝炎ウイルス由来肝細胞癌にて予後不良因子であることを報告した(Oncotarget, 2018)。加藤はメチル化酵素SUV420H1/KMT5B高発現が肝細胞癌における病理学的因子(多発・サイズ・脈管侵襲・悪性度など)に影響を及ぼし、5年全生存で独立した予後不良因子であることを報告した(図1, now submitting)。またRNAシークエンスを行ってGO解析を行い、in vitro/in vivoでのSUV420H1/KMT5Bの関与を証明した(図2,)。須崎がメチル化酵素と肝細胞癌、中村が肝内胆管癌、吉村が膵癌との関係性において研究中である。これらの研究を通し、2021年に保険収載されたファースト・イン・クラスのEZH2阻害剤であるタゼメトスタット臭化水素酸塩(タズベリク)に次ぐ、メチル化をターゲットとした阻害剤の開発を目指したいと考えている。
【図1】
全生存期間(OS)
【図2】
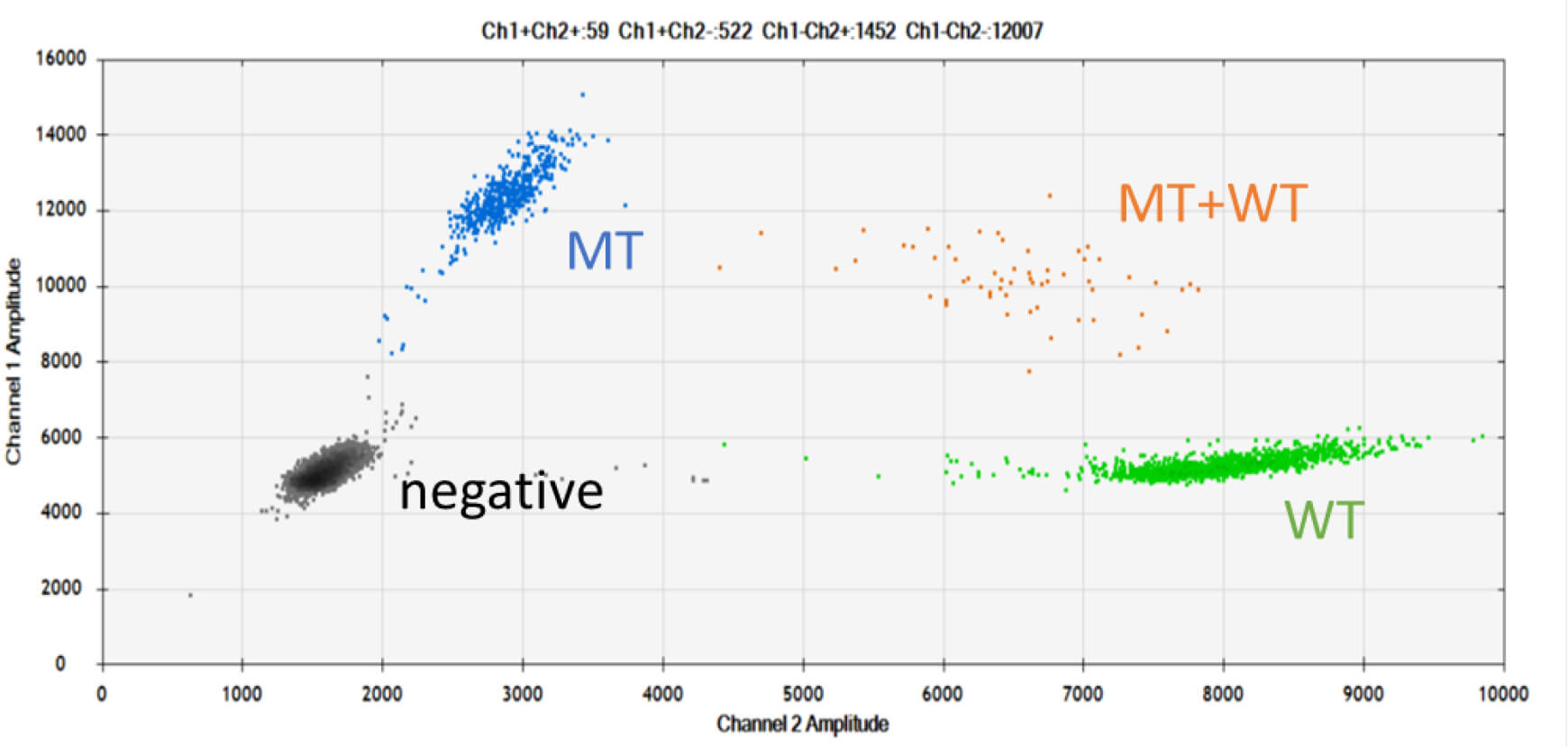
Droplet Digital PCRを
用いた新規研究
当教室では、2017年から新たにBIORAD社製のDroplet Digital PCR(ddPCR)を導入しました。ddPCRは、これまでにないアプローチで核酸の検出・定量を行い、統計的手法をとおして分子の絶対数を推量できるものです。現在、我々の教室では、血中腫瘍 DNA(circulating tumor DNA, ctDNA)やexosomeに着目し、ddPCRの技術を用いて膵癌をはじめとして大腸癌や食道癌におけるliquid biopsyとしてのバイオマーカーの可能性を探索しています。また、膵癌研究においては、術中におけるCirculating Tumor Cell(CTC)の研究にも応用して研究を始めています。